 Pas facile de savoir quand a vécu un animal quand on retrouve son squelette des milliers d'années plus tard. Heureusement, les archéologues ont un "espion" à leur disposition : le "carbone 14" !
Pas facile de savoir quand a vécu un animal quand on retrouve son squelette des milliers d'années plus tard. Heureusement, les archéologues ont un "espion" à leur disposition : le "carbone 14" !
Quel est le principe de la datation au carbone 14 ? Existe-t-il d'autres méthodes du même type pour mesurer l'âge des objets très anciens ? Suivez le guide !
Tout d'abord, qu'est ce que le carbone "14" ?
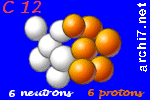 Quand on parle du carbone, on désigne a priori le carbone 12, qui est le plus répandu.
Quand on parle du carbone, on désigne a priori le carbone 12, qui est le plus répandu.
Il est constitué de 6 électrons tournant autour d'un noyau de 6 neutrons et 6 protons
(6 + 6 = 12 éléments dans son noyau, d'où le nom de carbone 12).
Mais, il existe deux autres "formes" de noyaux de carbone, que l'on appelle ses isotopes :
le carbone 13 et le carbone 14.
Chacun de ces isotopes comporte 6 protons dans son noyau (sinon, ce ne serait plus du carbone...) mais le carbone 13 a 7 neutrons et le carbone 14 en a 8.
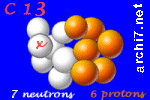
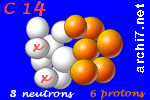
Chacun a aussi 6 électrons (pour compenser la charge électrique des 6 protons)... et ça a son importance car cela veut dire que ces atomes de carbone réagissent tous de la même façon quand ils rencontrent d'autres atomes avec qui ils peuvent former des molécules.
Dans la nature, les proportions entre les différents isotopes du carbone sont toujours les mêmes :
98,89% de carbone 12,
1,1% de carbone 13,
1,2.10-12 % de carbone 14.
Naissance du Carbone 14 ...
Le carbone 14 naît d'une collision entre un atome d'azote de l'air avec un neutron (dans la haute atmosphère, les rayons cosmiques créent de nombreux neutrons qui se balladent quelques temps tous seuls avant de trouver un noyau où se loger).
Cette réaction de formation du carbone 14, établie en 1946 par Willard Franck Libby, est la suivante :
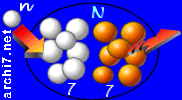
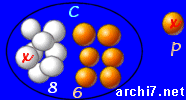
- un neutron frappe un atome d'azote (noté "N", qui a 7 protons, 7 neutrons),
- il rentre dans le noyau et en expulse un proton
Si bien qu'au final, il reste un atome de carbone (avec 6 protons et 8 neutrons) et un proton isolé (que l'on appelle aussi "noyau d'hydrogène").
![]()
Sa vie, son oeuvre ...
 L'atome de carbone 14 poursuit sa petite vie comme tout atome de carbone. Et, en particulier, il peut s'oxyder pour former une molécule de CO2. Il a donc une chance de s'installer tôt ou tard dans le cycle de la vie en étant respiré par un animal ou intégré à une plante.
L'atome de carbone 14 poursuit sa petite vie comme tout atome de carbone. Et, en particulier, il peut s'oxyder pour former une molécule de CO2. Il a donc une chance de s'installer tôt ou tard dans le cycle de la vie en étant respiré par un animal ou intégré à une plante.
Et il en va ainsi de millions de ces molécules de CO2 un peu particulières puisque leur atome de carbone est en fait un atome de carbone 14 ...
Fin de l'histoire ? Et bien, non !
Car, le carbone 14 est instable. Cela veut dire que son état "normal" n'est pas d'avoir 8 neutrons, mais 6 seulement. Et donc, fatalement, il redeviendra un carbone 12 un jour ou l'autre en perdant ces 2 neutrons.
Son retour à l'état de carbone 12 ...
En fait, comme tous les noyaux trop riches en neutrons, il est ce qu'on appelle "radioactif Béta moins".
Cela veut dire que, dans le noyau, l'un des neutrons se transforme en proton, en produisant un électron et un neutrino.
 Ce nouvel électron est éjecté du noyau, accompagné du neutrino qui emmène avec lui l'excédent d'énergie que cette réaction a produite.
Ce nouvel électron est éjecté du noyau, accompagné du neutrino qui emmène avec lui l'excédent d'énergie que cette réaction a produite.
![]()
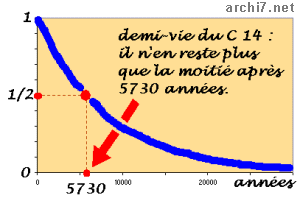
Cela se passe lentement : en 5 730 ans, la moitié des atomes de Carbone 14 sont redevenus des atomes de Carbone 12.
Mais ce phénomène est très régulier, selon la courbe décroissante exponentielle représentée ici en bleu.
Et la datation dans tout ça ?
Oui, oui, patience, on y revient ...
Si vous avez suivi, vous savez maintenant que tout être vivant comporte une certaine quantité d'atomes de carbone 14 qui se désintègrent lentement pour redevenir du carbone 12.
 Tant que l'organisme vivant reste vivant, il renouvelle son stock de carbone 14 puisqu'il mange et respire ...
Tant que l'organisme vivant reste vivant, il renouvelle son stock de carbone 14 puisqu'il mange et respire ...
Si bien que tout être vivant (humain, animal ou végétal) contient une proportion relativement constante de carbone 14 : un millionième de l'ensemble de ses atomes de carbone.
Mais, cette proportion diminue inexorablement après sa mort puisqu'il n'y a plus d'apport en carbone 14 !
Et voilà, nous y sommes : en mesurant la proportion de carbone 14 restant dans un organisme après sa mort, on peut déterminer depuis quand il a cessé de vivre !
La mesure se fait soit avec un appareil sensible à la radioactivité béta (on compte les "coups par minute" produit par un échantillon du fossile à dater), soit avec un « spectrographe de masse » couplé à un accélérateur de particules (un appareillage sensible à la différence de masse des atomes de carbone 14 et de carbone 12 qui a l'avantage d'être plus sensible et de pouvoir travailler sur de très petits échantillons de quelques milligrammes).
Limites de la datation au carbone 14
A cause de la décroissance de la quantité de carbone 14 avec le temps, après 50 000 ans, il ne reste plus assez de carbone 14 pour faire une mesure fiable (souvenez-vous que le carbone 14 ne représente déjà qu'un millionième des atomes de carbone le jour même de la mort...).
 Ensuite, la datation au carbone 14 n'est applicable qu'aux êtres vivants (ou aux roches qui contiennent de petits organismes vivants) car on ne peut tester que des "objets" contenant du carbone, autrement dit de la matière organique !
Ensuite, la datation au carbone 14 n'est applicable qu'aux êtres vivants (ou aux roches qui contiennent de petits organismes vivants) car on ne peut tester que des "objets" contenant du carbone, autrement dit de la matière organique !
La datation au carbone 14 est donc utilisable pour des êtres vivants (animaux ou végétaux) qui ont cessé de vivre il y a moins de 50 000 ans.
Autre petit détail :
si elle peut dater l'ancienneté d'un morceau de bois par exemple, elle ne peut pas dater quand quelqu'un l'a transformé en bateau Viking ou en cuiller à soupe...
Autres techniques de datation
Il y a plusieurs autres éléments radioactifs dans les organismes vivants, mais aussi dans les roches elles-mêmes. Et certains ont des demi-vies bien plus longues, comme ces éléments (avec leur demi-vie) : le Potassium 40 (1,3 milliards d'années), l'Uranium 238 (4,5 milliards d'années) et le Rubidium 87 (47 milliards d'années). L'uranium 238 a une désintégration très complexe puisqu'il passe par différents états avant de devenir, finalement, du Plomb 206. Mais c'est aussi pour cela qu'il est très utile pour mesurer l'âge des roches. Et c'est d'ailleurs grâce à cette méthode, appelée "méthode Plomb-Plomb" que l'âge de notre bonne vieille Terre a été estimée en 1953 par un jeune physicien américain Clair Patterson à 4,55 milliards d'années !
L'uranium 238 a une désintégration très complexe puisqu'il passe par différents états avant de devenir, finalement, du Plomb 206. Mais c'est aussi pour cela qu'il est très utile pour mesurer l'âge des roches. Et c'est d'ailleurs grâce à cette méthode, appelée "méthode Plomb-Plomb" que l'âge de notre bonne vieille Terre a été estimée en 1953 par un jeune physicien américain Clair Patterson à 4,55 milliards d'années !







 Vous avez une question... et Archi7 n'y a pas encore répondu ?
Vous avez une question... et Archi7 n'y a pas encore répondu ?