 On parle de pics d'ozone quand l'air en contient trop. Et d'un autre côté, il est question d'un trou d'ozone dans l'atmosphère terrestre...
On parle de pics d'ozone quand l'air en contient trop. Et d'un autre côté, il est question d'un trou d'ozone dans l'atmosphère terrestre...
Ca ne serait pas un peu contradictoire ?
Et bien non, car le même gaz peut jouer des rôles différents selon l'endroit où il se trouve !
Rencontre avec ce gaz aux deux visages, dont les quantités dans l'air sont dangeureusement perturbées par les activités humaines.
| exosphère | 10 000 km |
Petit rappel sur la structure de l'atmosphère terrestreLa couche d'air qui entoure la Terre et que l'on appelle "atmosphère" se divise en plusieurs couches. Pour l'ozone, celles qui nous intéressent particulièrement sont les deux plus basses : la troposphère qui fait 12 km de haut en partant du sol et la stratosphère, juste au-dessus, qui a une quarantaine de kilomètres d'épaisseur. Car la présence d'ozone dans l'atmosphère pose deux problèmes bien distincts : son role n'est pas (du tout) le même selon son emplacement !
Qu'est-ce que l'ozone ?
L'ozone est naturellement présent dans l'atmosphère terrestre, mais il doit être - et rester ! - en concentration très différente dans la stratosphère et dans la troposphère car sa présence a des impacts très différents selon l'altitude. |
| thermosphère | 700 km | |
| mésosphère | 80 km | |
| stratosphère | 50 km | |
| troposphère | 12 km | |
| sol |
L'ozone dans la stratosphère
 L'ozone stratosphérique est présent dans une couche d'une trentaine de kilomètres, située entre 12 et 40 km au-dessus de nos têtes.
L'ozone stratosphérique est présent dans une couche d'une trentaine de kilomètres, située entre 12 et 40 km au-dessus de nos têtes.
La concentration en molécules d'ozone y est de quelques dizaines de ppm, dans un mélange gazeux à faible pression, avec des écarts entre les pôles et l'équateur.
Endommager ce "bouclier" en le perçant ou en le rendant plus fin est une folie car il est primordial : il intercepte 97% des rayons ultraviolets du Soleil (et notamment les UV-C qui sont les plus nocifs pour les êtres vivants car ils pénètrent dans les cellules). Or très très peu de formes de vie terrestres supporteraient plus que les 3% d'UV solaires qui parviennent du coup jusqu'au sol.
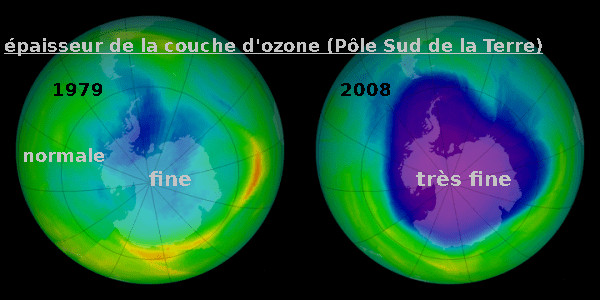 Pourtant, sa détérioration a été le premier signe d'un changement de l'atmosphère du à l'Homme...
Pourtant, sa détérioration a été le premier signe d'un changement de l'atmosphère du à l'Homme...
Et ça ne s'améliore pas au fil des ans : l'ozone stratosphérique
- est globalement en diminution partout (-4% en concentration tous les 10 ans depuis 1970)
- et à un niveau dramatique au dessus des pôles sud et nord (on observe de vrais "trous" dans la couche d'ozone depuis la fin des années 1970).
Dans la stratosphère, la diminution de la quantité d'ozone affaiblit la "couche d'ozone".
Cela nous expose à plus de rayons UV et donc à plus de cancers de la peau (et autres modifications accidentelles de l'ADN des êtres vivants...)
 sur les effets des UV sur la peau, lire : Pourquoi bronze-t-on ?
sur les effets des UV sur la peau, lire : Pourquoi bronze-t-on ?
L'ozone dans la troposphère
L'ozone troposphérique, au niveau du sol et jusqu'à une douzaine de kilomètres, se trouve dans l'air que l'on respire.
Or l'ozone agresse le système respiratoire des animaux et nuit aux poumons, aux reins, au cerveau et aux yeux, sans compter qu'il peut brûler les végétaux les plus sensibles.
Ses effets sur notre santé dépendent de sa concentration dans l'air et du volume d'air que l'on respire.
Et quand il s'agit de surveiller le taux d'ozone d'un point de vue médical, on se base sur des moyennes horaires, en utilisant une autre unité, les µg/m3 : 1 µg/m3 équivaut à 0,467.10-3 ppm ou 1 ppm d'ozone vaut 2140 µg/m3.
 En ce moment, en Europe, on s'estime "satisfait" si l'ozone ne dépasse pas 120 μg/m3 (0,056 ppm) plus de 25 jours par an (valeur cible).
En ce moment, en Europe, on s'estime "satisfait" si l'ozone ne dépasse pas 120 μg/m3 (0,056 ppm) plus de 25 jours par an (valeur cible).
Et lors des "pics d'ozone", on informe la population à partir de 180 μg/m3 (0,084 ppm) et on lance une alerte à partir de 240 μg/m3 (0,11 ppm).
C'est bien sympa de nous alerter à 0,11 ppm... mais si vous souvenez du début de la page, tout être humain "moyen" le sent lui-même à partir de 0,1 ppm... et ces "limites officielles" se basent sur des moyennes sur 8 heures, donc sur des chiffres qui "lissent" d'éventuels pics de concentration.
Ces pics instantanés ont pourtant leur importance : à partir de 0,2 ppm (428 μg/m3) commencent à apparaître des troubles de la vision, des troubles neurologiques (comme des vertiges, des asthénies (un "coup de mou"), une altération du goût, des troubles de la parole, une mauvaise coordination du mouvement, etc...) d'autant plus remarqués si on est en train de faire du sport (car on respire plus) ou que l'on est "fragile" (car très jeune, très vieux ou déjà atteint d'une faiblesse pulmonaire). Et l'exposition à l'ozone a aussi une importance dans la durée : être exposé souvent à des concentrations jugées "plutôt bonnes" est en fait mauvais du fait de l'accumulation....
Quand la quantité d'ozone augmente dans la troposphère, nous en respirons trop et cela est très nocif pour le système respiratoire et le corps dans son ensemble.
(la carte présentée n'a pas été "choisie", c'est celle fournie par le site prevair.org le jour de la rédaction de cet article)
Il est donc "logique" que l'on s'inquiète de "pas assez" d'ozone dans la stratosphère
et de "trop" d'ozone dans la troposphère...
Mais d'où vient le déséquilibre actuel dans la quantité d'ozone ?
L’ozone est naturellement produit dans la partie haute de l'atmosphère terrestre à partir de dioxygène 02
 Au delà de 30 km au dessus du sol, les rayons solaires de l'atmosphère ont encore assez d'énergie pour briser en deux atomes d'oxygène (O) des molécules de dioxygène (02).
Au delà de 30 km au dessus du sol, les rayons solaires de l'atmosphère ont encore assez d'énergie pour briser en deux atomes d'oxygène (O) des molécules de dioxygène (02).
Ainsi libéré, un atome d'oxygène est très instable... et se dépêche de trouver une molécule de O2 à qui se coller... pour former une molécule d'ozone.
Celà se passe donc en deux temps :
D'abord : O2 → O + O (sous l'effet du rayonnement solaire)
Ensuite, très rapidement : O + O2 → O3
Une certaine quantité d'ozone est ainsi apparue lors de la formation de l'atmosphère qui entoure la Terre, il y a plus de 2 milliards d'années, lorsque la quantité d'oxygène s'y est stabilisé pour représenter environ 1% de l'air.
Mais, l'ozone n'est pas très stable (en tout cas, bien moins que le dioxygène 02).  De façon spontanée, un atome d'oxygène et d'une molécule d'ozone peuvent se recomposer pour donner deux molécules de dioxygène : O3 + O → 2 O2
De façon spontanée, un atome d'oxygène et d'une molécule d'ozone peuvent se recomposer pour donner deux molécules de dioxygène : O3 + O → 2 O2
C'est ce qui se se passe essentiellement quand l'ozone se trouve à l'ombre (sans lumière directe du soleil), la nuit et plus particulièrement au moment des longues nuits polaires, au Pôle Nord et au Pôle Sud.
Quand il baigne dans la lumière solaire - donc "le jour" - le rayonnement solaire casse une certaine proportion d'ozone qui "redevient" du dihydrogène en se débarassant d'un atome d'oxygène : O3 → O2 + O

Avec ce petit jeu de transformation O3 ↔02 sous l'effet des rayons UV de la lumière solaire, un équilibre s'est créé et, depuis la formation de la Terre, l'ozone restait en proportion stable très haut dans la stratosphère, fidèle "bouclier anti-UV"...
 Mais il y a hélas un moyen de perturber ce fragile équilibre O3 ↔02 !
Mais il y a hélas un moyen de perturber ce fragile équilibre O3 ↔02 !
Des molécules "étrangères" à l'équilibre initial peuvent déstabiliser la proportion d'ozone de la haute atmosphère en entraînant une sur-production d'ozone ou, au contraire, une sous-production...
Si la production de O3 est favorisée, le bouclier devient trop fort et ne laisse plus passer assez d'UV
Si la destruction de 03 est favorisée, le bouclier devient trop faible et laisse passer trop d'UV

Or, depuis la révolution industrielle (et surtout depuis les années 1960), l'activité humaine relâche plusieurs molécules différentes qui favorisent la destruction de 03
Elles forcent l'ozone à se transformer en O2 car elles ont une forte tendance à "prendre les molécules de 03 pour un réservoir d'atome d'oxygène"... et leur efficacité à détruire l'ozone est diabolique ! Jugez plutôt à partir de ce petit inventaire...
La famille des CFC
La famille des chloro-fluoro-carbones (comme le trichlorofluorométhane CFCl3, le dichlorodifluorométhane CF2Cl2, etc...) a été pulvérisée dans l'air pendant presque tout le 20ème siècle : ce sont des gaz très pratiques à utiliser qui servaient de liquides de refroidissement dans les réfrigérateurs, de produits nettoyant, de gaz propulseur dans les pulvérisateurs de toutes sortes (déodorants, désodorisants d'atmosphère, peinture en bombe, etc...)...
Mais - gros problème !! - lâchées au niveau du sol, ces molécules montent en altitude et en arrivant dans le haut de la troposphère (une quinzaine d'années plus tard), elles se décomposent à cause des UV... et chaque atome de chlore libéré entame alors un processus dévastateur :
- un atome de chlore prend un atome d'oxygène à l'ozone pour former un oxyde de chlore (ClO) :
Cl + O3 → ClO + O2 - puis chaque molécule de ClO détruit une nouvelle molécule d'ozone pour reformer l'atome de chlore du départ :
ClO + O3 → Cl + 2 O2
Résultat ? Chaque atome de chlore détruit 2 molécules d'ozone... puis réapparaît : il peut recommencer !
Très utilisées dans les vaporisateurs pendant des années, les CFC ont été interdits progressivement par un accord international signé en 1989 avec obligation de s'en passer totalement à partir de 2005...
Cela n'a pas fait disparaître les molécules de chlore qui étaient déjà dans l'atmosphère (elles continueront de détruire l'ozone au moins jusqu'en 2050)...
Mais heureusement qu'on a arrêté d'en disperser davantage : voici l'évolution que les scientifiques avaient calculé sinon !
 En 2040, il y aurait eu un indice UV d'au moins 15 sur les continents habités...
En 2040, il y aurait eu un indice UV d'au moins 15 sur les continents habités...
et une perte de 67% de l'ozone en 2060 : la Terre serait devenue tout simplement invivable pour les êtres humains !
( les détails de ces calculs sont sur le site NASA - Earth Observatory, en anglais)
les détails de ces calculs sont sur le site NASA - Earth Observatory, en anglais)
Par contre, les CFC ont du coup été largement remplacés par des HCFC (hydrochlorofluorocarbures)... qui relâchent moins d'atomes de chlore dans la haute atmosphère mais sont des gaz à effet de serre !
Leur interdiction a elle aussi été programmée (en 1992) mais avec des délais incroyables : leur utilisation commence à être restreinte progressivement depuis 1996... mais ils seront seulement totalement interdits à partir de 2030 (voire 2040 pour certains pays).
Les molécules contenant du brome les plus dangereuses - utilisées comme pesticides dans l'agriculture - sont elles-aussi interdites depuis 2015.
Mais on continue à disperser joyeusement chaque jour des oxydes d'azotes (NOx) : le monoxyde d'azote NO et le redoutable dioxyde d'azote NO2 (fruit de la transformation du NO) sont produits dès qu'on "brûle" quelque chose, dans nos moteurs de voitures, dans nos cheminées ou dans les centrales de production d'énergie...
Eux détruisent aussi l'ozone en altitude en plus d'être très nocifs pour notre santé dès qu'ils se trouvent dans l'air que nous respirons !
La production de NOx s'accompagne aussi de production de particules plus ou moins fines très néfastes à notre santé...
Où suivre les évolutions de l'ozone jour après jour ?
Les indices de pollution de l'air sont un reflet de l'ensemble des polluants (y compris l'ozone) au niveau du sol.
Ils peuvent être consultés - polluant par polluant - chaque jour sur des sites d'observation comme prevair.org pour l'Europe.
L'évolution de la couche d'ozone en altitude est disponible sur le site NASA Ozone Watch et les prévisions de la quantité d'ozone dans la troposphère sont sur le site ESA - TEMIS






 L'ozone - aussi appelé trioxygène - est la molécule O3, composée de 3 atomes d'oxygène.
L'ozone - aussi appelé trioxygène - est la molécule O3, composée de 3 atomes d'oxygène. 
 Vous avez une question... et Archi7 n'y a pas encore répondu ?
Vous avez une question... et Archi7 n'y a pas encore répondu ?